فناوری های فوتونیک و لیزر:
تصویربرداری دو فوتونی سیناپس های مغز را در طول بیهوشی طولانی مدت نظارت می کند!
مطالعه اخیر بر روی تصویربرداری سیناپسی دو فوتونی از مغز موش در طول بیهوشی طولانی، تغییرات ساختاری عمده ای را در سیناپس ها نشان داد.
*نیوشا فقانخانی
آرایش سیناپس ها در مدارهای مغز،واسطه نحوه یادگیری، به خاطر سپردن و فراموشی افراد است. از زمان معرفی تصویربرداری دو فوتونی به علوم اعصاب ، از آن برای تصویربرداری از اتصالات سیناپسی در مغز حیوانات زنده استفاده شده است. تصویربرداری دو فوتونی همچنین تغییراتی را در عملکرد عصبی نشان داده است که زمینه ساز بیماریهای عصبی روانپزشکی مانند صرع، مولتیپل اسکلروزیس و اسکیزوفرنی است.
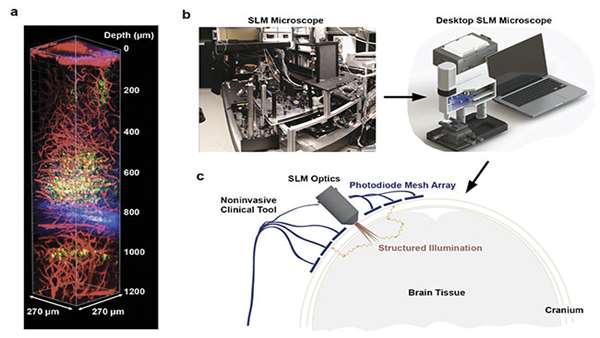
مطالعه اخیر بر روی تصویربرداری سیناپسی دو فوتونی از مغز موش در طول بیهوشی طولانی، تغییرات ساختاری عمده ای را در سیناپس ها نشان داد. به عنوان یک اقدام حیاتی برای نجات جان، اغما طولانیمدت پزشکی (pMIC)میلیونها بار در سال بر روی بیماران در بخشهای مراقبتهای ویژه در سراسر جهان انجام میشود. اثرات درازمدت سلامتی بر بیمارانی که از COVID-19 شدید جان سالم به در برده اند و نیاز به حمایت مکانیکی تنفسی داشتند، ممکن است برای سال های زیادی قابل درک نباشد. تا یک سوم بیماران ICU که نیاز به حمایت مکانیکی تنفسی دارند دچار اختلال شناختی می شوند. حدس زده شده است که این پیشرفت نه تنها به بیماری های زمینه ای مربوط می شود، بلکه به اثرات مستقیم خود بیهوشی نیز مربوط می شود. در حالی که شواهدی وجود دارد که نشان می دهد داروهای بیهوشی می توانند منجر به تغییرات سیناپسی و اختلال شناختی در کودکان شود، تا همین اواخر، هیچ شواهدی از چنین اثراتی در بزرگسالان وجود نداشت. متاسفانه چون که دلایل اختلال شناختی در بیماران بدحال پس از pMIC به طور کامل شناخته نشده است، استراتژیهای درمانی سیستماتیک برای به حداقل رساندن این اختلالات در مدار مغز در طول بیهوشی طولانیمدت ایجاد نشده است و دستورالعملهای بالینی متناسب با بیمار در رابطه با ترکیبات بیهوشی در حال حاضر وجود ندارد. از زمان اختراع میکروسکوپ فلورسانس دو فوتونی، مطالعه مدارهای عصبی در مغز زنده حیوانات با وضوح درون سلولی و در مدت زمان طولانی از نظر فنی ممکن شده است. در حالی که روشهای تصویربرداری میکروسکوپی کنونی هنوز از وضوح عمق محدود (در بهترین حالت، تا چند میلیمتر زیر سطح مغز) رنج میبرند. در آزمایش های انجام شده در قشر مغزی موش بالغ بدون بیماری، بیشتذ (بیش از 95٪) خارهای دندریتیک در یک بازه زمانی یک ماهه با نیمه عمر بیشتر از 13 ماه ثابت ماندند. هنگامی که سیناپس های قشری در طول یک دوره 6 ساعته pMIC یا کمای مصنوعی در موش های بالغ در یک مطالعه اخیر تحت نظر قرار گرفتند، هیچ تغییر قابل توجهی در دینامیک خار های دندریتیک مشاهده نشد. نگهداری موش ها در کمای ناشی از پزشکی تحت شرایط پایدار برای دوره های طولانی نیز دشوار است زیرا در مقایسه با بیماران انسانی، موشها متابولیسم، ضربان قلب و ضربان تنفس بسیار تسریعشدهای دارند، همراه با نسبت وزن بدن به سطح که آنها را مستعد کاهش سریع دمای بدن در طول شرایط استراحت ناشی از pMIC میکند. اخیراً یک چارچوب تجربی ایجاد شده است که pMIC را در موشها (تا 40 ساعت) در ترکیب با تصویربرداری مزمن دو فوتونی با وضوح سیناپسی از سیناپسهای قشر مغز و ارزیابی مکرر رفتاری ممکن میسازد. در این آزمایش مشخص شد که برخلاف تصور رایج، pMIC بدون در نظر گرفتن سن حیوان، اثرات جانبی قابل توجهی بر ساختار سیناپسی مغز دارد. در طول pMIC، مغز سیناپسهای بیشتری را نسبت به شرایط عادی تشکیل میدهد. پس از قطع این روش، مغز به طور نامتناسبی ارتباطات سیناپسی را از دست می دهد. این شکل گیری غیراختصاصی و غیرطبیعی اتصالات عصبی ممکن است به اختلال شناختی در بیماران pMIC کمک کند زیرا سیناپس های اضافی می توانند با عملکرد طبیعی عصبی تداخل داشته باشند. مطالعه آزمایشی تصویربرداری دو فوتونی اثرات جانبی ساختاری و عملکردی قابل توجهی از pMIC را شناسایی کرد و نشان داد که معماری سیناپسی مغز بزرگسالان بسیار کمتر از آنچه قبلا تصور می شد پایدار است. در این مطالعه به طور انحصاری از ایزوفلوران، یک بیهوش کننده استنشاقی، به دلیل سینتیک سریع آن استفاده شد که امکان تنظیم سریع عمق بیهوشی را فراهم می کند. این امکان وجود دارد که داروهای بیهوشی خاص یا ترکیبی از آنها اثرات مخرب کمتری بر معماری سیناپسی مغز نسبت به سایرین داشته باشد. در سطح فنی، تکنیکهای نوری اسکن لیزری مانند تصویربرداری با دو فوتون را میتوان بدون ایجاد آسیب در انسان مورد استفاده قرار داد زیرا این روش از نور لیزر پالسی در محدوده نزدیک به مادون قرمز (750 تا 2500 نانومتر) استفاده میکند که امکان نفوذ و ضبط را بدون آسیب رساندن به مغز فراهم میکند. تعدیلکنندههای نور فضایی (SLMs) میتوانند برای کوچکسازی فناوری تصویربرداری استفاده شوند، که میتواند برای تصویربرداری عمقی مغز روی جمجمه نصب شود.
با این حال، عوامل متعددی انجام تصویربرداری دو فوتونی را در انسان دشوار می کند. اول اینکه ادغام میکروسکوپ دو فوتونی در جریان کار بالینی به دلیل تصویربرداری اضافی که می تواند بر رفاه بیمار تأثیر بگذارد، مدت زمان عمل را تا حد زیادی افزایش می دهد. دوماینکه این تکنیک وضوح عمق محدودی را ارائه می دهد و سوم، برای کاهش خطر آسیب رساندن به بافت نمونهبرداری شده، تحقیقات بیشتری در مورد شاخصهای فلورسنت غیرسمی برای برچسبگذاری نورونها در مغز انسان در حال انجام است. فناوری تصویربرداری چند فوتونی میتواند دانش مار را از رفتار سیناپس مغزی را ارتقا دهد و در پی آن میتوان عملکرد بهتری در درمان بیمار داشت.
*دانشگاه شهید بهشتی، محقق در حوزه لیزر و فوتونیک
منابع:
M. Wenzel et al. (2021). Prolonged anesthesia alters brain synaptic architecture. Proc Natl Acad Sci, Vol. 118, No. 7, e2023676118, www.doi.org/10.1073/pnas.2023676118.
P.P. Pandharipande et al. (2013). Long-term cognitive impairment after critical illness. N Engl J Med, Vol. 369, No. 14, pp. 1306-1316, www.nejm.org/doi/abs/10.1056/nejmoa1301372.
S.J. Finnema et al. (2016). Imaging synaptic density in the living human brain. Sci Transl Med, Vol. 8, No. 348, pp. 1-10, www.doi.org/10.1126/scitranslmed.aaf6667.
. J. Grutzendler et al. (2002). Long-term dendritic spine stability in the adult cortex. Nature, Vol. 420, No. 6917, pp. 812-816, www.doi.org/10.1038/nature01276.
. G. Yang et al. (2011). Transient effects of anesthetics on dendritic spines and filopodia in the living mouse cortex. Anesthesiology, Vol. 115, No. 4, pp. 718-726, www.doi.org/10.1097/aln.0b013e318229a660.
. W. Chen et al. (2017). Giant five-photon absorption from multidimensional core-shell halide perovskite colloidal nanocrystals. Nat Commun, Vol. 8, Article No. 15198, www.doi.org/10.1038/ncomms15198.
. V. Nikolenko et al. (2010). A portable laser photostimulation and imaging microscope. J Neural Eng, Vol. 7, No. 4, www.doi.org/10.1088/1741-2560/7/4/045001.
. W. Yang and R. Yuste (2017). In vivo imaging of neural activity. Nat Methods, Vol. 14, No. 4, pp. 349-359, www.doi.org/10.1038/nmeth.4230.
. M. Bojtár et al. (2019). Green-light activatable, water-soluble red-shifted coumarin photocages. Org Lett, Vol. 21, No. 23, pp. 9410-9414, www.doi.org/10.1021/acs.orglett.9b03624.
. Y. Hontani et al. (2021). Multicolor three-photon fluorescence imaging with single-wavelength excitation deep in mouse brain. Sci Adv, Vol. 7, Issue 12, www.doi.org/10.1126/sciadv.abf3531
_1.png)

_2.png)
ارسال به دوستان